ENLASES QUIMICOS
¿QUE SON LOS ENLASES QUIMICOS?
Los enlaces químicos son las fuerzas que mantienen unidos los átomos para formar las moléculas. Hay tres tipos de enlaces entre átomos: metálico, iónico y covalente. Gracias a estos enlaces se forman todos los compuestos que existen en la naturaleza.
Los seres vivos se componen de átomos, pero en la mayoría de los casos, esos átomos no están flotando por ahí individualmente. Por el contrario, generalmente están interactuando con otros átomos (o grupos de átomos).
Como ejemplo, los átomos podrían estar conectados por enlaces fuertes y organizados en moléculas o cristales; o podrían formar enlaces temporales y débiles con otros átomos con los que chocan o rozan. Tanto los enlaces fuertes, que mantienen unidas a las moléculas, como los enlaces más débiles que crean conexiones temporales, son esenciales para la química de nuestros cuerpos y la existencia de la vida misma.
¿Por qué formar enlaces químicos? La respuesta fundamental es que los átomos están tratando de alcanzar el estado más estable (de menor energía) posible. Muchos átomos se vuelven estables cuando su
orbital de valencia está lleno de electrones o cuando satisfacen la regla del octeto (al tener ocho electrones de valencia). Si los átomos no tienen este arreglo, "desearán" lograrlo al ganar, perder o compartir electrones mediante los enlaces.
Los iones y los enlaces iónicos
Algunos átomos se vuelven más estables al ganar o perder un electrón completo (o varios electrones). Cuando lo hacen, los átomos forman iones, o partículas cargadas. El ganar o perder electrones le puede dar a un átomo una capa electrónica externa llena y hacer que sea energéticamente más estable.
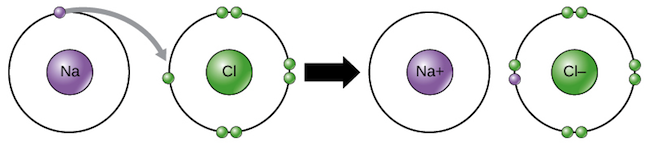
La formación de iones
Los iones pueden ser de dos tipos. Los
cationes son iones positivos que se forman al perder electrones. Por ejemplo, un átomo de sodio pierde un electrón para convertirse en un catión sodio,
Na+start text, N, a, end text, start superscript, plus, end superscript. Los iones negativos se forman al ganar electrones y se llaman
aniones. Los aniones reciben nombres que terminan en "-uro"; por ejemplo, el anión del cloro (
Cl−start text, C, l, end text, start superscript, minus, end superscript) se llama cloruro.
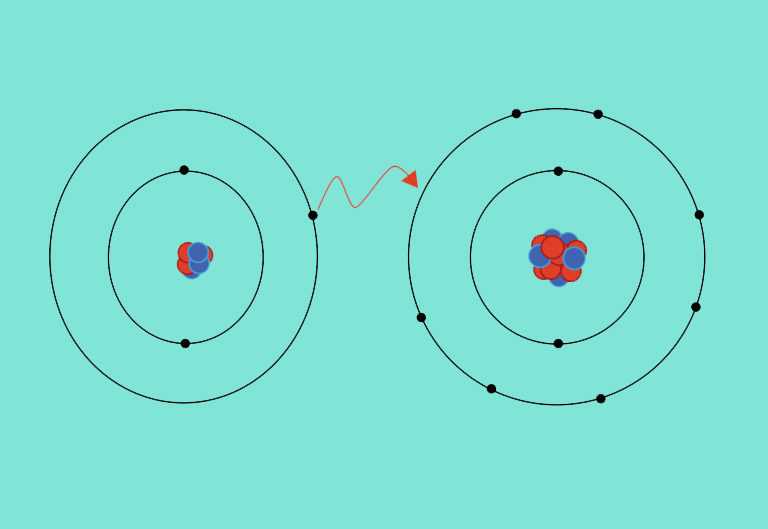
Cuando un átomo pierde un electrón y otro átomo gana un electrón, el proceso se conoce como transferencia de electrones. Los átomos de sodio y de cloro son un buen ejemplo de transferencia de electrones.
El sodio (Na) solo tiene un electrón en su capa electrónica externa, por lo que es más fácil (más electrónicamente estable) que el sodio done ese electrón a que encuentre siete electrónes más para llenar su capa externa. Debido a esto, el sodio tiende a perder su único electrón y formar Na
+start superscript, plus, end superscript.
Por otra parte, el cloro (Cl), tiene siete electrones en su capa externa. En este caso, es más fácil para el cloro ganar un electrón que perder siete, entonces tiende a tomar un electrón y contertirse en Cl
−start superscript, minus, end superscript.
Cuando se combinan el sodio y el cloro, el sodio donará su electrón para vaciar su capa más externa, y el cloro aceptará ese electrón para llenar la suya. Ahora ambos iones satisfacen la regla del octeto y tienen capas externas completas. Dado que el número de electrones ya no es igual al número de protones, cada átomo se ha convertido en un ion y tiene una carga +1 (Na
+start superscript, plus, end superscript) o –1 (Cl
−start superscript, minus, end superscript)
En general, un átomo debe perder un electrón al mismo tiempo que otro átomo gana un electrón: para que un átomo de sodio pierda un electrón, necesita tener un receptor adecuado como un átomo de cloro.
La formación de un enlace iónico
Los
enlaces iónicos son enlaces que se forman entre iones con cargas opuestas. Por ejemplo, los iones sodio cargados positivamente y los iones cloruro cargados negativamente se atraen entre sí para formar cloruro de sodio o sal de mesa. La sal de mesa, al igual que muchos compuestos iónicos, no se compone solo de un ion sodio y un ion de cloruro; por el contrario, contiene muchos iones acomodados en un patrón tridimensional predecible y repetido (un cristal).
1start superscript, 1, end superscriptEn la fisiología, ciertos iones se conocen como electrolitos (como sodio, potasio y calcio). Estos iones son necesarios para la conducción de impulsos nerviosos, la contracción muscular y el equilibrio de agua. Muchas bebidas deportivas y suplementos dietéticos proporcionan iones para reponer aquellos que se pierden durante el ejercicio por la sudoración.
Enlaces covalentes
Otra manera como los átomos se vuelven más estables es al compartir electrones (en lugar de ganarlos o perderlos por completo), formando así enlaces covalentes. Estos enlaces son mas comunes que los enlaces iónicos en las moléculas de los organismos vivos.
Por ejemplo, los enlaces iónicos son clave para la estructura de las moléculas orgánicas basadas en el carbono, como nuestro ADN y proteínas. También hay enlaces covalentes en moléculas inorgánicas más pequeñas, tales como
H2Ostart text, H, end text, start subscript, 2, end subscript, start text, O, end text,
CO2start text, C, O, end text, start subscript, 2, end subscript, y
O2start text, O, end text, start subscript, 2, end subscript. Se pueden compartir uno, dos o tres pares de electrones, lo que resulta en enlaces simples, dobles o triples, respectivamente. Entre más electrones compartan dos átomos, más fuerte será el enlace.
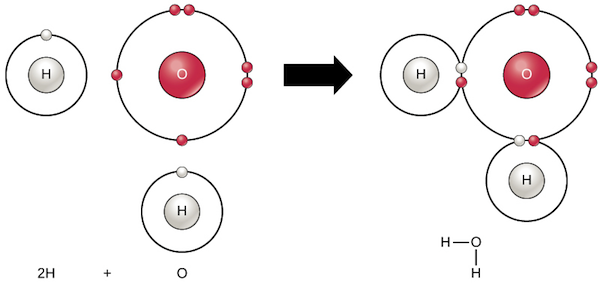
Como ejemplo de enlace covalente, examinemos el agua. Una sola molécula de agua,
H2Ostart text, H, end text, start subscript, 2, end subscript, start text, O, end text, está compuesta de dos átomos de hidrógeno unidos a un átmo de oxígeno. Cada hidrógeno comparte un electrón con el oxígeno y el oxígeno comparte uno de sus electrones con cada hidrógeno:
Los electrones compartidos dividen su tiempo entre las capas de valencia de los átomos de hidrógeno y oxígeno, y le dan a cada átomo algo que se parece a una capa de valencia completa (dos electrones para el H, y ocho para el O). Esto hace que una molécula de agua sea mucho más estable de lo que serían los átomos que la componen por sí solos.
Enlaces covalentes polares
Hay dos tipos principales de enlaces covalentes: polar y no polar. En un enlace covalente polar, los electrones se comparten de forma no equitativa entre los átomos y pasan más tiempo cerca de un átomo que del otro. Debido a la distribución desigual de electrones entre los átomos de diferentes elementos, aparecen cargas ligeramente positivas (δ+) y ligeramente negativas (δ–) en distintas partes de la molécula.
En una molécula de agua (arriba), el enlace que une al oxígeno con cada hidrógeno es un enlace polar. El oxígeno es un átomo mucho más electronegativo que el hidrógeno, por lo que el oxígeno del agua tiene una carga parcialmente negativa (tiene una densidad de electrones alta), mientras que los hidrógenos llevan cargas parcialmente positivas (tienen una densidad electrónica baja).
En general, la electronegatividad relativa de los dos átomos en un enlace, es decir su tendencia a acaparar los electrones compartidos, determinará si el enlace es polar o no polar. Siempre que un elemento sea significativamente más electronegativo que otro, el enlace entre ellos será polar; esto significa que uno de sus extremos tendrá una carga ligeramente positiva y el otro una carga ligeramente negativa.
Enlaces covalentes no polares
Los
enlaces covalentes no polares se forman entre dos átomos del mismo elemento o entre átomos de diferentes elementos que comparten electrones de manera más o menos equitativa. Por ejemplo, el oxígeno molecular (
O2start text, O, end text, start subscript, 2, end subscript) no es polar porque los electrones se comparten equitativamente entre los dos átomos de oxígeno.
Otro ejemplo de enlace covalente no polar puede encontrarse en el metano (
CH4start text, C, H, end text, start subscript, 4, end subscript). El carbono tiene cuatro electrones en su capa exterior y requiere cuatro más para volverse un octeto estable. Los consigue al compartir electrones con cuatro átomos de hidrógeno, cada uno de los cuales le provee de un electrón. Del mismo modo, los átomos de hidrógeno necesitan un electrón adicional cada uno para llenar su capa más externa, los cuales reciben en forma de electrones compartidos del carbono. Aunque el carbono y el hidrógeno no tienen exactamente la misma electronegatividad, son bastante similares, así que los enlaces carbono-hidrógeno se consideran no polares.
¿Cómo se forman los enlaces químicos?
Los enlaces químicos se forman ganando, cediendo o compartiendo electrones para alcanzar configuraciones electrónicas estables como por ejemplo las de los gases nobles.
Los átomos electropositivos ceden electrones hasta completar la configuración más estable, con lo que quedan con un defecto de carga negativa. Los elementos electronegativos por su parte capturan electrones y quedan con un exceso de carga negativa. Las entidades así formadas se llaman iones: cationes si la carga resulta positiva (+) y aniones si es negativa (-). Entre ambas partículas cargadas puede establecerse un enlace iónico, formándose una sal.
En otras ocasiones dos átomos comparten pares de electrones y quedan enlazados formando una molécula, de manera que la configuración de la nube electrónica que ahora rodea a los dos núcleos resulta más estable. Los electrones compartidos pueden proceder de ambos átomos, lo que se conoce como enlaces covalentes, típicos en los materiales de origen biológico, o de uno solo de ellos, en cuyo caso caso se dice que el enlace es covalente coordinado, muy habituales en los elementos de transición.
Otra posibilidad es que muchos átomos de elementos metálicos compartan electrones entre todos. En estos casos se forma una red ordenada de átomos y los electrones compartidos se mueven libremente entre ellos. Es lo que se conoce como enlace metálICO.
Comentarios
Publicar un comentario